Senyawa kovalen memiliki ikatan kovalen. Tolong jawabannya ya makasihh INI JAWABAN TERBAIK Perbedaan senyawa ion dan senyawa kovalen.

Download Menghantarkan Images For Free
Perbedaan wujud senyawa kovalen dan ion disebabkan ikatan-ikatan kovalen pada senyawa kovalen yang relatif lemah dan.

. Di dalam air molekul HCl tersebut dapat terurai karena pengaruh air yang juga bersifat polar sehingga membentuk ion-ion H dan Cl -. Senyawa kovalen tidak larut dalam pelarut polar namun larut dalam pelarut organik. Misalnya HCl ini senyawa kovalen polar.
Titik didih dan titik leleh yang tinggi. HF asam florida. Oleh sebab itu larutan yang bersumber dari senyawa ionik dapat menghantarkan arus listrik dengan baik dan termasuk ke dalam larutan elektrolit kuat.
Senyawa ion tersusun dari ion-ion yang bentuknya padat dan kering. Dua jenis utama ikatan kimia adalah ikatan ionik dan kovalen. Namun mengapa pada senyawa kovalen HCl mampu menghantarkan listrik.
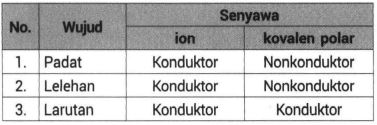
Akan tetapi cairan senyawa ion akan menghantarkan listrik karena ion-ionnya menjadi lepas dan bebas. Cairan dan larutan dapat menghantarkan arus listrik. Senyawa NaCl hanya dapat menghantarkan listrik jika dilarutkan atau dilelehkan sementara jika dalam bentuk kristal atau padatan NaCl tidak dapat menghantarkan listrik karena ion tidak dapat bergerak bebas.
Senyawa kovalen tidak larut dalam pelarut polar namun larut dalam pelarut organik. Senyawa ion tidak dapat menghantarkan listrik ketika dalam keadaan padatan namun bisa menghantarkan listrik jika dilarutkan dalam pelarut polar. Logam mempunyai sifat fisik sebagai berikut.
Dalam keadaan murni HCl secara teori tidak menghantarkan arus listrik kecuali. Ion-ion penyusun senyawa ion dalam pelarutnya akan bergerak bebas sehingga. Senyawa kovalen tidak dapat menghantarkan listrik.
Senyawa kovalen berwujud lunak dan tidak mudah rapuh. Pada senyawa kovalen di samping itu elektron bersama oleh. Meski demikian senyawa kovalen dan ionik memiliki beberapa perbedaan dalam menghantarkan arus listrik.
Senyawa kovalen berwujud lunak dan tidak mudah rapuh. Sifat Fisik Senyawa Kovalen Senyawa kovalen adalah senyawa yang terbentuk dari penggunaan bersama pasangan elektron oleh dua atom berikatan. Hal ini karena senyawa ionik dalam bentuk cair dan larutan larut membentuk ion positif dan ion negatif sehingga ion ini akan membawa arus listrik.
Senyawa ion juga dapat menghantarkan listrik bila dilarutkan dalam pelarut polar misalnya air karena terionisasi. Karena kuatnya ikatan antara ion positif dan negatif maka senyawa ion berupa padatan dan berbentuk kristal. Karena sifat inilah senyawa polar mampu menghantarkan arus listrik.
HCl merupakan senyawa kovalen polar yang berarti mempunyai kutub-kutub positif dan negatif akibat adanya perbedaan keelektronegatifan. Beberapa senyawa kovalen polar yang larut dalam air ada yang dapat menghantarkan arus listrik karena dapat terhidrolisis membentuk ion ion. Berikut ini ringkasan singkat perbedaan antara ikatan ion dan kovalen sifat-sifatnya dan cara mengenalinya.
Senyawa kovalen memiliki ikatan di mana elektron dibagi antara atom. Perbedaan antara senyawa ionik dan kovalen dapat membingungkan. Senyawa kovalen memiliki titik didih dan titik leleh yang rendah.
Senyawa ion yang terbentuk dari interaksi elektrostatik yang kuat antara ion yang menghasilkan titik leleh yang lebih tinggi dan konduktivitas listrik dibandingkan dengan senyawa kovalen. Hal ini karena ion positif dan ion negatif saling tarik menarik ke segala arah oleh gaya elektrostatik. Senyawa kovalen bersifat polar.
Senyawa ionik membantu untuk menghantarkan listrik dalam air karena mereka membawa muatan. Lelehan wujud ini dapat menghantarkan listrik karena dalam bentuk lelehan ion-ionnya bergerak relatif bebas. Kecuali jika ikatan kovalen polar tersebut terputus secara heterolitik pemutusan ikatan dengan pembagian elektron tidak sembang hingga membentuk ion positif dan ion negatif barulah senyawa itu dapat menghantarkan listrik.
Ikatan ionik adalah ikatan yang dihasilkan dari perpindahan elektron dari satu atom ke atom lain. Karena berbagi elektron mereka menunjukkan sifat fisik karakteristik yang meliputi. Satu atom memberikan satu atau lebih dari elektron.
Senyawa ion juga dapat menghantarkan listrik bila dilarutkan dalam pelarut polar misalnya air karena terionisasi. Senyawa kovalen tidak dapat menghantarkan listrik. Senyawa ion memiliki ikatan ion dalam bentuk lelehan dan larutan dapat terionisasi sempurna menghasilkan ion-ion yang dapat bergerak bebas.
Senyawa yang dalam larutannya dapat menghantarkan arus listrik berupa senyawa ion dan senyawa kovalen polar karena senyawa-senyawa tersebut dapat terionisasi saat dilarutkan dalam air. Senyawa kovalen terdiri dari molekul-molekul yang memiliki sifat netral dan tidak dapat menghantarkan listrik. Senyawa ion juga lebih larut.
Namun apabila senyawa ion ini dilarutkan maka ion-nya mampu bergerak bebas sehingga bisa menghantarkan listrik. Padatan wujud ini tidak dapat menghantarkan listrik karena dalam bentuk padatan tidak ada ion yang bergerak secara bebas. Rapuh sehingga hancur jika terkena.
Pada senyawa ionik elektron diberikan dari atom dari satu unsur ke unsur lainnya. SEORANG PENGGUNA TELAH BERTANYA Jelaskan perbedaan antara senyawa kovalen dan senyawa ion serta berikan contohnya. Untuk memahami perbedaan wujud senyawa ionik dan kovalen polar ini berikut penjelasannya.
Senyawa dengan ikatan kovalen biasanya memiliki entalpi penguapan dan fusi yang lebih rendah. Dapat menghantarkan arus listrik. Senyawa ini terdiri dari ion-ion yang bergerak bebas dalam pelarutnya contohnya larutan NaCl dimana terdiri dari ion Na dan ion Cl.
ContohPembentukan NaCl Na ----- Na e Cl2 e ---- 2 Cl- Senyawa yang termasuk senyawa elektrolit antara lainNaClKClNaBrCaClNa 2SO4 Ada beberapa senyawa kovalen yang tergolong dalam senyawa elektrolit yaitu jika dilarutkan dalam air akan menghasilkan ion-ion yang dapat menghantarkan arus listrikContohHClHBrHNO3H2SO4 Senywa ini. Ikatan ionik pada dasarnya menyumbangkan elektron ke atom lain yang berpartisipasi dalam ikatan sementara elektron dalam ikatan kovalen dibagi secara merata di. Senyawa ionik adalah senyawa yang atom-atomnya berikatan secara ionik.
Ion-ion dalam larutan HCl inilah yang berperan sebagai penghantar listrik. Definisi dasar dari suatu senyawa ionik adalah bahwa mereka adalah molekul yang terdiri dari ion bermuatan. Karena mereka tidak mengandung ion.
Senyawa ion berwujud padat tidak menghantarkan listrik karena ion positif dan negatif terikat kuat satu sama lain.

Sebutkan Perbedaan Sifat Antara Senyawa Ion Dengan Senyawa Kovalen Brainly Co Id
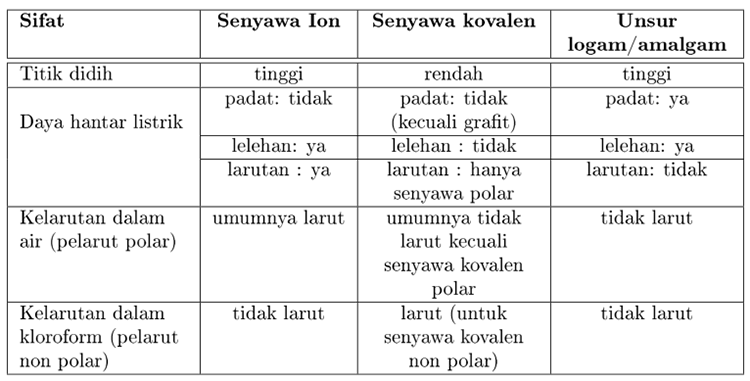
Modul Rumus Soal Sifat Fisis Senyawa Wardaya College

Ciri Ciri Dari Senyawa Ion Dan Senyawa Kovalen Brainly Co Id

Mengapa Lelehan Senyawa Kovalen Polar Tidak Dapat Menghantarkan Listrik Sedangkan Lelehan Ion Dapat Menghantarkan Listrik

Perbedaan Senyawa Ion Dan Senyawa Kovalen Youtube

Perbedaan Senyawa Ion Senyawa Kovalen Dan Lo Utakatikotak Com

Top 10 Jelaskan Perbedaan Daya Hantar Listrik Dari Senyawa Ion Dan Senyawa Kovalen Yang Berupa Padatan 2022
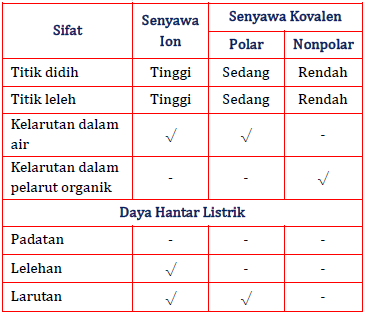
Diketahui Data Fisik Dua Buah Senyawa Sebagai Beri

Bandingkan Sifat Senyawa Ionik Dan Senyawa Kovalen

Mengapa Leburan Senyawa Ion Dapat Menghantarkan Listrik Sedangkan Senyawa Ion

Mengapa Lelehan Senyawa Kovalen Polar Tidak Dapat Menghantarkan Listrik Sedangkan Lelehan Ion Dapat Menghantarkan Listrik

Catatan Tentang Larutan Elektrolit Sma Clear Kimia Belajar Hafalan
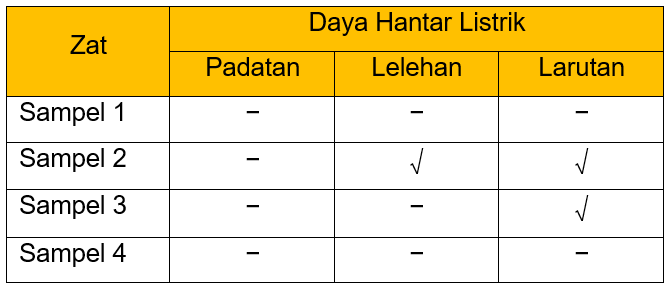
Disajikan Data Hasil Pengujian Daya Hantar Listrik

Pengertian Sifat Dan Contoh Dari Senyawa Ion Panduan Kimia Riset
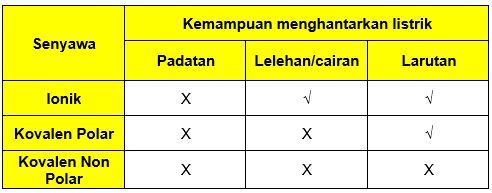
Perhatikan Beberapa Zat Berikut Asam Klorida
Perbedaan Sifat Senyawa Ion Dan Senyawa Kovalen Po

Daya Hantar Listrik Senyawa Ion Kovalen Polar Kovalen Nonpolar Part 8 Otosection

Daya Hantar Listrik Senyawa Ion Kovalen Polar Kovalen Nonpolar Part 8 Otosection

Perhatikan Sifat Sifat Senyawa Berikut Yang T
